החיסון נגד נגיף סרטן צוואר הרחם
טיפול בסרטן: מניעה בשלוש רמות
מחלות הסרטן מאופיינות בנוכחות תאים סרטניים בגוף. בתאים אלה התחוללה סדרת מוטציות, שגרמה להם להתחלק באופן בלתי מבוקר. התאים הסרטניים יוצרים גוש או לחלופין מתפשטים, תופסים מקום ומפריעים לאיברים שונים. בשלבים מתקדמים, גם תאים יוצרי-גוש יכולים לנדוד ברחבי הגוף וליצור גרורות - גידולים משניים.
סרטן איננו מחלה אחת, אלא קבוצה של מחלות, וסוג הסרטן נקבע לפי סוג האיבר וסוג התאים שבהם מתפתח הגידול. לימפומה, למשל, היא סרטן של קשרי הלימפה, ואילו מלנומות הן גידולים ממאירים של התאים המייצרים את הפיגמנט מלנין.
מחלות הסרטן הן אחד האתגרים החשובים ביותר העומדים בפני הרפואה המודרנית. בכל שנה מאובחנים בישראל כ-23,500 חולים חדשים במחלות השייכות לקבוצת מחלות הסרטן. אפשר להתייחס לטיפול בסרטן כאל מניעה בשלוש רמות: מניעה ראשונית היא מניעה של הופעת הגידול מלכתחילה, על-ידי צמצום החשיפה לגורמי הסיכון. מניעה שניונית מוגדרת כהגבלת ממדי הגידול, וזו נעשית בעיקר באמצעות אבחון מוקדם. מניעה שלישונית היא חסימת ההתפשטות של גרורות.
מובן שמניעה ראשונית באוכלוסייה בריאה היא האפשרות המועדפת, ואכן נעשית הסברה רבה על גורמי סיכון כגון עישון, אלכוהול, קרינה, מאכלים שומניים וכדומה. לאחרונה התפתח ענף חדש בתחום המניעה הראשונית - פיתוח חיסונים כנגד נגיפים הגורמים לסוגי סרטן מסוימים.
חיסון נגד דלקת כבד (הפטיטיס) מסוג B, לדוגמה, הוריד מאוד את התחלואה בסרטן הכבד, ואילו החיסונים החדשים נגד נגיף הפפילומה מהווים פריצת דרך רפואית, ומצליחים למנוע ביעילות הקרובה ל־100 אחוזים הידבקות בנגיפים הגורמים לסרטן צוואר הרחם.
נגיף הפפילומה והסרטן
נגיפי הפפילומה נפוצים הן באדם והן בבעלי-חיים אחרים, מדביקים את העור ואת הרקמות הריריות ומועברים בעיקר ביחסי מין. למעשה, נגיפים אלה הם גורם המחלה הנפוץ ביותר המועבר ביחסי מין. באדם זוהו יותר מ־100 זנים שונים של נגיף הפפילומה של האדם (HPV, human papilloma virus); רוב הזנים גורמים ליבלות, בדרך-כלל על איברי המין, ואילו קבוצה קטנה מעורבת בהתמרה סרטנית.
 |
| תמונת מיקרוסקופ אלקטרונים של נגיפי פפילומה של האדם (הצבעים הוספו לתמונה לשם הדגשה) |
למשל, הזנים המכונים HPV16 ו-HPV18 שייכים לקבוצה המסוכנת ואחראים לכ-70% ממקרי סרטן צוואר הרחם. לעומתם, הזנים HPV6 ו-HPV11 אחראים ליבלות באיברי המין.
נגיף הפפילומה חודר דרך פצעים זעירים ברקמת העור, ומדביק את התאים הבזליים (תאים בשכבה התחתונה של אפיתל העור, שעדיין אינם ממוינים). מחזור הרבייה של הנגיף מתואם עם התמיינות התאים. עם החדירה לתא הבזלי, הנגיף גורם להגברת קצב החלוקה של התאים, דבר המביא ליצירת יבלת על פני העור. אם הזן המדביק נמנה עם הזנים הגורמים לסרטן, התאים שנדבקו מאבדים את היכולת להתמיין (לקבל תפקיד מוגדר). לעומת זאת, בזנים גורמי-היבלות הנגיפים מבשילים לאורך תהליך התמיינות התא, ולבסוף נוצרים נגיפים חדשים. כאשר התאים מגיעים לשכבה העליונה של העור ומתים - שהרי השכבה העליונה ביותר של העור, החשופה לפגעי הסביבה, מורכבת מתאים מתים - הנגיפים יוצאים מהם.
 |
| תרשים של איברי הרבייה של האשה |
החומר התורשתי של נגיפי הפפילומה הוא DNA שצורתו מעגלית. בתא שמתחוללת בו התמרה סרטנית, מולקולת ה-DNA המעגלית של הנגיף נפתחת, משתלבת בתוך ה-DNA הגרעיני של התא ומשתכפלת במהלך חלוקת התא. בתא שאינו עובר התמרה סרטנית, ה-DNA הנגיפי מתקיים באופן חופשי בגרעיני התאים המודבקים, כלומר מצוי כאפיזום.
החלבונים המקודדים על־ידי ה-DNA הנגיפי מבוטאים בתאים מודבקים (לא סרטניים) בהדרגה: תחילה הגנים המכונים ״הגנים המוקדמים״, הקשורים בשכפול החומר התורשתי הנגיפי, ולאחר מכן ״הגנים המאוחרים״ המקודדים יצירת חלבונים של המעטפת החלבונית (קפסיד) של הנגיף.
בעוד שהגנים המאוחרים פעילים רק בשלבים האחרונים של התמיינות התאים, ואינם פעילים כלל במצבים ממאירים, הגנים ה״מוקדמים״, המכונים E6 ו-E7, הם בעלי תפקיד בהתמרה הסרטנית. גנים נגיפיים אלה אחראים ליצירת חלבונים המפריעים לפעולתם של חלבונים תאיים, המעורבים בהגנה על התא מפני שינויים ממאירים. החלבונים הללו מקודדים על-ידי גנים הנקראים "גנים מדכאי גידולים”(Tumor suppressor genes), משום שתפקידם לעכב את מחזור התא או לגרום ל״התאבדות״ (אפופטוזה) של התא אם נגרם נזק בלתי הפיך ל-DNA שלו. כאשר החלבונים הנגיפיים מעכבים את ״מדכאי הגידולים״ של התא, תאים שה-DNA שלהם ניזוק יכולים להתחלק ולהתרבות.
מחקרים העלו כי ה-DNA הנגיפי של נגיף הפפילומה, ה-HPV, נמצא ב-99.7% מדגימות התאים של סרטן צוואר הרחם. אף על פי כן, חשוב להבין שההדבקה כשלעצמה אינה מהווה תנאי מספיק להתפתחות גידול סרטני, אלא דרושים אירועים נוספים. יתר על כן, הנגיף יכול להישאר במצב בלתי פעיל במשך שנים מרגע ההדבקה. למרבה המזל, אפילו ההדבקה בזנים המסוכנים ביותר של הנגיף אינה מובילה בדרך-כלל למחלה, הודות למערכת החיסון של הגוף, המצליחה כרגיל להתגבר על הנגיף.
מדוע חיסון?
חיסון הוכח זה כבר כאמצעי היעיל ביותר למלחמה במחלות זיהומיות. החיסון המונע ניתן לאנשים בריאים על מנת למנוע הידבקות במחלה טרם החשיפה לגורם הזיהומי, ותופעות הלוואי של החיסון הן לרוב מצומצמות.
הטיפול המוצלח ביותר בסרטן הוא למנוע את המחלה - אך קשה למדי להימנע לחלוטין מגורמים מסרטנים. לפיכך, אין זה מפתיע שרעיון החיסון נגד סרטן קסם לרבים. ביוני 2006 אישר מנהל המזון והתרופות האמריקני (FDA) את השימוש בתרכיב החיסון גרדסיל (Gardasil) של חברת מרק (Merck). זהו חיסון מונע כנגד נגיף הפפילומה של האדם. תרכיב חיסון נוסף, הקרו סרבריקס (Cervarix), שמייצרת חברת גלקסו-סמית-קליין (GlaxoSmithKline), כבר אושר לשימוש באוסטרליה.
פיתוח החיסון
הידע הקיים בתחום החיסונים נגד סרטן הצטבר בעיקר בעקבות ניסויים בבעלי־חיים. המודלים המקובלים הם השתלת גידולים בגופם של בעלי-החיים; או השריית גידולים באמצעות חשיפה לגורמים מסרטנים; או השריית שינויים גנטיים מכוונים.
קצב התקדמות הגידול בעכברים מהונדסים גנטית הוא אטי יחסית לקצב התקדמות גידול המושתל בעכבר, ולפיכך מתאפשרת אינטראקציה בין הגידול לבין מערכת החיסון של העכבר. בפיתוח החיסון נגד נגיף הפפילומה, נעשו ניסויים רבים בזני נגיף שאינם מדביקים בני-אדם, משום שזני הפפילומה של האדם (הזנים ה״אנושיים״), כשמם כן הם - מדביקים בני-אדם בלבד.
במקרה של נגיף הפפילומה של האדם, חיסון המבוסס על נגיף מוחלש אינו אפשרי בשל הסכנה שבדבר: כאמור,
הנגיף מכיל גנים המעודדים התמרה סרטנית (אונקוגנים).
החיסון פותח לבסוף בשיטות של הנדסה גנטית, תוך שימוש בחלבון הנגיפי L1 כאנטיגן, קרי, מולקולה המעוררת את מערכת החיסון לייצר נוגדנים כנגדה. החלבון L1 הוא אחד החלבונים ה״מאוחרים״ של הנגיף, והוא אחד החלבונים החשובים במעטפת החלבונית של הנגיף. החיסון איננו מכיל, אם כן, חומר תורשתי נגיפי, היכול לחדור לתאים ולעבור שכפול, אלא רק חלבון אחד של הנגיף, ולכן איננו עלול לגרום להתמרה סרטנית.
בשלב הניסויים הקליניים בבני-אדם, נעשו ניסויים בחיסונים המבוססים על תערובות של חלבון L1 מזני הנגיפים המסוכנים ביותר. תרכיב החיסון הראשון שאושר לשימוש הוא הגרדסיל.
תרכיב הגרדסיל
הגרדסיל הוא חיסון"מרובע״, המבוסס על חלבון L1 של נגיפי הפפילומה מזנים HPV16 ו-HPV18 כנגד סרטן צוואר הרחם, והזנים HPV6 ו-HPV11 כנגד יבלות על איברי המין. בעזרת תאי שמרים יצרה חברת מרק חלקיקים דמויי- נגיף (virus like particles), שהם חלקיקים בעלי מעטפת חלבונית של הנגיף, אך חסרים את החומר התורשתי הנגיפי. חלקיקים אלה מסוגלים לעורר את מערכת החיסון, אך אינם מסוכנים, כיוון שאין בהם DNA, ולכן אינם יכולים להדביק תאים או להתרבות בהם.
כמקובל בחיסונים, גרדסיל כולל לא רק את החומר הפעיל, אלא גם חומר שנועד להגביר את התגובה החיסונית (adjuvant). במקרה זה, משתמשים במלחי אלומיניום.
המחקר הקליני נערך על 12,000 נשים צעירות ובריאות בגילים 26-16. טווח גילים זה נבחר לצורך המחקר הראשוני על סמך ההנחה, שאלה הם הגילים שבהם רוב הנשים באות במגע מיני עם בני-זוג חדשים ונשקפת להן סכנת הדבקה. כל נערה או אשה קיבלה את חיסון הגרדסיל או פלסבו (כביקורת). המחקר היה כפול־סמיות (double blind), כלומר, המידע על השתייכותה של כל משתתפת לקבוצת הניסוי או לקבוצת הביקורת נשאר חסוי הן מן הרופאים והן מן הנשים המשתתפות. החיסון ניתן ב־3 מנות, כאשר זמן מתן החיסון הראשון הוגדר כזמן 0, החיסון השני ניתן לאחר חודשיים והחיסון השלישי לאחר 6 חודשים. מן המחקר עולה כי במהלך תקופת המעקב החיסון היה יעיל ב־100 אחוזים במניעת הופעת יבלות ושינויים טרום- סרטניים שגורמים ארבעת זני הנגיף שנגדם כוון. התברר כי לא היה יתרון למחוסנות מבחינת עמידותן לנגיפי פפילומה מזנים אחרים. כן נמצא כי התגובה לחיסון מתחילה כ-3 חודשים לאחר מתן החיסון הראשון, ומגיעה לערכה המרבי כחודש לאחר מתן החיסון האחרון. ממחקרים נוספים שנערכו על קבוצות נוספות עלו תוצאות דומות.
בהמשך נערכו שני מחקרים נוספים להערכת התגובה החיסונית (כמות הנוגדנים) בעקבות החיסון בילדות ונערות בגילים 15-9, על מנת להעריך את יעילות החיסון גם בגילים צעירים. נמצא שהיעילות דומה, ולכן אושר החיסון גם לגילים אלה.
המסקנות על יעילות החיסון מוגבלות לטווח זמן של כ-5 שנים מרגע החיסון, שכן הניסויים הקליניים הופסקו לאחר פרק זמן זה מסיבות אתיות - כדי לאפשר לנשים שהשתייכו לקבוצות הביקורת לקבל את החיסון, שהוכח כיעיל.
תרכיב הסרבריקס
תרכיב הסרבריקס (Cervarix) מיועד כנגד הזנים HPV16ו-HPV18 (הגורמים להתמרה סרטנית) בלבד, והמחקרים בו נערכו בנשים שגילן עד 45, במטרה לאשר את השימוש בו גם לאוכלוסייה זו.
גם חיסון זה מבוסס על יצירת חלקיקים דמויי-נגיף הכוללים את החלבון הנגיפי L1, אך המערכת שבה פיתחו החוקרים את החלקיקים המהונדסים היא תאי חרק (לעומת מערכת תאי שמרים בתרכיב הגרדסיל). הבדל נוסף הוא שימוש בתכשיר מיוחד (תערובת המכונה AS04) כמסייע לתגובה החיסונית (לעומת מלחי אלומיניום בחיסון הגרדסיל), כדי לקבל תגובה חיסונית בעלת יעילות גבוהה יותר ולהאריך את משך ההגנה שמקנה החיסון.
מי צריך להתחסן?
רצוי לקבל את החיסון טרם תחילת קיום יחסי מין. עם זאת, גם נשים שנדבקו באחד הזנים לפני החיסון תזכינה בהגנה מפני הזנים האחרים. נוסף על כך, ייתכן שהחיסון ימנע או יצמצם את העברת הנגיף לבן הזוג. כמו כן ייתכן, שמתן החיסון לנשים הסובלות מיבלות באיברי המין יצמצם את העברת הנגיף ליילוד (הנגיף עלול לגרום לכשלי נשימה ביילודים). אף שלא נתגלו בעיות בנשים הרות שהשתתפו בניסוי, חיסון נשים בהיריון אינו מומלץ בשלב זה, משום שהיתה קבוצה קטנה למדי של אוכלוסייה זו בין המשתתפות במחקר.
האם גם לגברים כדאי להתחסן? יעילות החיסון בגברים נחקרת כעת. סביר להניח שחיסון זה יוכל לצמצם את התחלואה בסרטן פי הטבעת, בסרטן הפין (איבר הזכרות) ובסרטן הלוע והפה, הנגרמים אף הם בסבירות גבוהה כתוצאה מהדבקה בנגיף הפפילומה, בדרך-כלל בעקבות קיום יחסי מין. מובן שחיסון הגברים יסייע גם בהגנה על הנשים מהדבקה בנגיף במהלך יחסי מין. חברת מרק עורכת בימים אלה ניסוי על מנת לבדוק את יעילות החיסון בגברים, אף שיש מדינות, ובהן אוסטרליה ובריטניה, שאינן ממתינות לתוצאותיו. מכל מקום, בישראל חיסון הגרדסיל מאושר כיום לשימוש לנערות ולנשים בגילי 26-9.
האם יט סכנה בחיסון?
חיסון המיועד לאוכלוסייה בריאה מעורר תמיד חשד רב יותר מאשר תרופה שנועדה לרפא מחלה באדם חולה. תופעות הלוואי, הנסבלות אולי לדידו של מי שאין לו ברירה, הן חמורות בהרבה מנקודת מבטו של מי שרוצה להתחסן בפני מחלה אפשרית עתידית. כך, לדוגמה, במחלת המלנומה ישנו טיפול שתופעת לוואי שלו היא הופעת אזורי עור נטולי פיגמנט (התופעה מכונה vitiligo). בעוד שעבור החולים תופעת לוואי זו מהווה הוכחה ליעילות הטיפול, מובן שחיסון מונע (לאוכלוסייה בריאה) הגורם לתופעת לוואי כה קשה - לא יאושר.
במחקרים לגבי החיסונים החדשים לא נתגלו תופעות לוואי חמורות. התקבלו בעיקר דיווחים על חום חולף או נפיחות קלה במקום ההזרקה. לגבי דיווחים חמורים יותר, לא הוכח קשר סיבתי למתן התרכיב. החוקרים בדקו גם, אם חיסון כנגד ארבעה זני נגיף מסוימים יגרום לעלייה בתחלואה כתוצאה מזני הנגיף האחרים. בזמן המחקר לא נראו עדויות לתופעה כזו, ממצא התואם את המצופה, שכן לא ידוע על תחרות בין הזנים.
אף על פי כן, יש לזכור כי משך הניסויים היה קצר יחסית, ודרושים מחקרים נוספים׳ על מנת להסיק מסקנות ארוכות-טווח יותר.
אמצעים אחרים
ברמת מניעת ההדבקה, ישנן ראיות לכך שאמצעים נוספים (כגון שימוש בקונדומים ומילת גברים) יכולים לצמצם את העברת הנגיף, אם כי יעילות החיסון גבוהה יותר במניעת ההדבקה. ובכל זאת, מכיוון שהחיסון אינו מגן מפני כל זני הנגיף המסוכנים וכן אינו מועיל כנגד הדבקה קיימת, אין הוא מבטל את הצורך בשיטות הסקר המוקדם כגון משטחי צוואר הרחם (Pap smear; ראו תיבה). שילוב השיטות הקודמות עם החיסון החדש מסתמן כדרך המניעה הרצויה: מחקרים הראו, כי דרך המניעה הטובה ביותר היא קבלת תרכיב חיסון נגד הנגיף בגיל העשרה, ובדיקות משטחי צוואר הרחם החל מגיל 25.
מבט לעתיד
החיסון, כאמור, מהווה פריצת דרך רפואית משמעותית. עם זאת, רבות הן השאלות שטרם קיבלו מענה ודורשות מחקר המשך. בראש ובראשונה, יש להמשיך לבחון את בטיחות החיסון. נוסף על כך, יש לבנות מודל מתמטי שיקבע מהו החיסון המיטבי. על מודל כזה להביא בחשבון גורמים רבים: מספר זני הנגיף שכנגדם יפעל החיסון, אוכלוסיית היעד (מין, גיל, אוכלוסיות מיוחדות כגון מדוכאי חיסון), החלבון הנגיפי שעליו מבוסס החיסון (האם לכלול בחיסון גם חלבון נגיפי נוסף?). כמו כן יש לברר באיזו מידה יעיל החיסון כנגד סוגי סרטן נוספים הנגרמים כתוצאה מנגיף הפפילומה.
סוגיית עלות החיסון גם היא קריטית, במיוחד לאור העובדה כי במדינות מתפתחות סרטן צוואר הרחם הוא נפוץ מאוד ותכניות המניעה והסריקה המוקדמת אינן נגישות.
הוזלת מחיר החיסון תתאפשר אם תפותח שיטה לחיסון בלא צורך במחטים (השימוש במחט הזרקה מחייב כוח אדם מיומן וציוד חד־פעמי); בלא צורך בקירור (על מנת לאפשר את הובלת החיסון בלא תנאים מיוחדים); ומתן חד־פעמי של החיסון (במקום הטיפול בשלוש מנות הניתן כיום).
נוסף על כך, יש לבדוק כיצד יפעל החיסון לא רק כמניעה, אלא גם בעידוד למערכת החיסונית כנגד גידול קיים.
בדיקת משטח צוואר הרחם
בדיקת משטח צוואר הרחם (Pap smear) נקראת על שם ממציאה, רופא בשם ג׳ורג' פאפאניקולו (Papanicolaou), שהגה את הרעיון בשנת 1920. בדיקת משטח צוואר הרחם היא בדיקה ציטולוגית, שבה נוטלים דגימת תאים מצוואר הרחם, והתאים נבדקים כדי לגלות אם התחוללו בהם שינויים טרום-ממאירים. ממצאים לא-תקינים של המשטח מחייבים בדיקת קולפוסקופיה (בדיקה של צוואר הרחם באמצעות מיקרוסקופ מיוחד), המאפשרת לאתר את מקור התאים הלא-תקינים. בדיקת משטח צוואר הרחם נערכת כפעם בשנה, לכל אשה המגיעה לביקורת שגרתית אצל רופא הנשים. בארצות-הברית ובמדינות מפותחות אחרות פחת שיעור התמותה מסרטן צוואר הרחם בעשרות אחוזים מאז הונהגה הבדיקה באופן שגרתי. נוסף על בדיקת משטח צוואר הרחם, אפשר לאסוף מצוואר הרחם תאים ולבדוק אם הם מכילים DNA של נגיף הפפילומה. בדיקה זו היא רבת-ערך, שכן היא מאפשרת זיהוי של הנגיף גם אם הוא מצוי במצב רדום ואינו פעיל בעת הבדיקה.
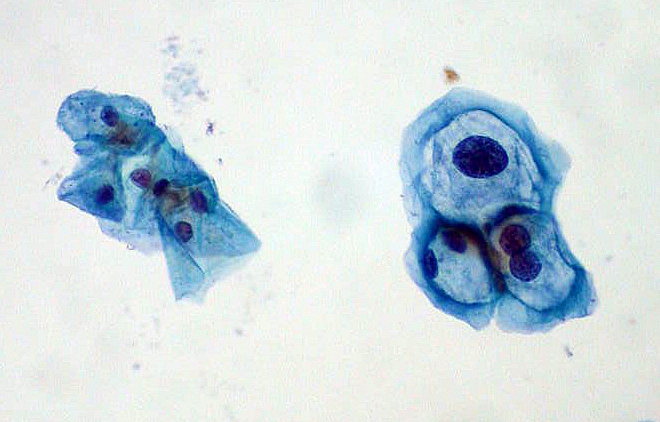 |
| תאים מבדיקת פאפ - לאבחון גידולים בצוואר הרחם. משמאל תאים תקינים, מימין תאים מודבקים בנגיפי פפילומה. המקור: Ed Uthman, Flicker |
תודה לפרופ׳ סטלה מיטרני־רוזנבאום על הערותיה המועילות.
דינה וולודרסקי היא תלמידת מחקר במכון ויצמן.
לקריאה נוספת
Your disease Risk - אתר מידע למניעת מחלות מטעם מרכז סייטמן לחקר הסרטן
דף סרטן צוואר הרחם באתר NCI, המכון הלאומי לחקר הסרטן בארצות-הברית
מרכז המידע של ארגון הבריאות העולמי (WHO/ICO) על HPV וסרטן צוואר הרחם
אתר על סרטן צוואר הרחם מטעם חברת מרק, יצרנית גרדסיל
פורסם בגליליאו 115, מרץ 2008
אין תגובות:
הוסף רשומת תגובה